广东省畜牧兽医学会是由广东省民政厅批准成立的具有法人资格的全省性社会团体,是广东省科学技术协会的组成部分,是党和政府联系畜牧兽医科技工作者的桥梁和纽带,是发展我省畜牧兽医事业的重要社会力量。现任理事长是廖明同志。
广东省畜牧兽医学会是由广东省民政厅批准成立的具有法人资格的全省性社会团体,是广东省科学技术协会的组成部分,是党和政府联系畜牧兽医科技工作者的桥梁和纽带,是发展我省畜牧兽医事业的重要社会力量。现任理事长是廖明同志。
摘 要:为了研究能够同时检测PEDV、TGEV、PoRV三种猪病毒性腹泻病原的方法,分别设计三套特异性的引物和探针,建立了基于Taqman探针的三重Real-Time RT-PCR检测方法,实验结果表明,该方法特异性好,灵敏度高,检测最低浓度为10 copies/μL数量级。应用该方法对广东11个地市的44份猪腹泻样品进行了检测,其中PEDV阳性率为100%,TGEV、PoRV阳性率为0,证明PEDV是引起广东地区猪病毒性腹泻的重要病原。
关键词:三重Real-Time RT-PCR;PEDV;TGEV;PoRV
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)、猪轮状病毒(Porcine rotavirus,PoRV)是传统上引起猪病毒性腹泻的主要病原,其中PEDV与TGEV同为冠状病毒,在电镜下外观相似;PoRV为呼肠孤病毒科成员,是引起人及幼畜腹泻的重要的人畜共患病原。此三种病毒在抗原性上无任何关系,但三个病原感染易感动物后在临床表现上存在诸多共同特征:主要通过粪-口途径传播,各年龄段的猪都可感染,以产房新生哺乳仔猪感染后症状最为严重;新生仔猪死亡率高,随着日龄增长,死亡率逐渐下降;一年四季可发病,在寒冷的冬、春两季发病最为普遍;发病仔猪临床症状非常相似,均表现为腹泻、呕吐、脱水和酸中毒,病理变化均呈现肠壁变薄、绒毛萎缩;三种病原既可单一感染,也可相互混合感染,因此,鉴别诊断非常困难。为了快速、精准诊断此三种猪病毒性腹泻病原,为动物疫病的预防和净化提供依据,本研究建立了基于Taqman探针的三重Real-Time RT-PCR检测方法,在同一管反应体系中同时检测三种荧光信号,每种荧光信号代表PEDV、TGEV、PoRV三种病毒中的一种,从而达到一次性检测并鉴别三种病毒的目的;同时,利用建立的方法进行了初步应用。
1材料和方法
1.1 材料
1.1.1 毒株、载体、样品
猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒、猪急性腹泻综合征冠状病毒毒株,由广东温氏集团研究院提供;猪瘟兔化弱毒C株,由广东永顺生物制药股份有限公司提供;临床检测样品,由珠海安富来生物科技有限公司采集;克隆载体PES(插入位点SmaⅠ),为上海旭冠生物科技发展有限公司产品。
1.1.2 主要试剂、仪器
AxyPrep体液病毒DNA/RNA小量试剂盒,美国Axygen公司产品;TaKaRa One Step Primescript RT-PCR Kit(Perfect Real Time),产品货号RR064A;Viia7 Real-Time PCR System,美国Applied Biosystems公司产品。
1.2 方法
1.2.1 Real-Time PCR引物、Taqman探针设计
根据GenBank发表的猪流行性腹泻病毒N蛋白基因、猪传染性胃肠炎病毒S糖蛋白基因、猪轮状病毒结构蛋白VP7基因序列,使用生物信息学软件DNAMAN进行序列比对后,选择高度保守区域,用Oligo7软件各设计一套Real-Time PCR引物、Taqman探针,由上海辉睿生物科技有限公司合成,见表1。
表1 引物和探针
Figure 1 Primers and TaqMan™ probes
1.2.2 阳性标准品的制备
将PEDV、TGEV、PoRV三个病毒上下游引物扩增的目的基因(分别为85bp、76bp、106bp),首尾相连进行拼接,在每个拼接点之间加入5个碱基对(ATCTA)作为保护。拼接序列进行化学合成,合成的拼接片段克隆到PES载体(约2692 bp)中,将该质粒作为阳性标准品,命名为PES-DNA(PEDV-TGEV-PoRV)。载体序列加上插入的基因序列(277 bp)共约2969 bp。基因化学合成与克隆委托上海旭冠生物科技有限公司完成。
1.2.3 三重Real-Time RT-PCR反应体系的建立
以PES-DNA(PEDV-TGEV-PoRV)为模板,进行Real-Time PCR扩增。反应体系为:2×Taq PCR Master mix 12.5 μL,逆转录酶0.5μL,Taq酶0.5 μL,PEDV、TGEV、PoRV上下游引物和Taqman探针各1.0 μL(10 μmol/L),模版2.0 μL,补水至25 μL。反应程序为:42℃ 5 min;94℃ 15 s,55℃ 40 s(收集荧光信号),40 Cycles。每一反应管均同时收集FAM、VIC、ROX三个通道的荧光信号。
1.2.4 三重Real-Time RT-PCR特异性试验
单独提取猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒、猪急性腹泻综合征冠状病毒(SADS-CoV) 广东分离株、猪瘟兔化弱毒C株的RNA,分别以这5种RNA为模板,在三重Real-Time RT-PCR反应体系下,用单一模板RNA逐个检测,验证特异性。
1.2.5 三重Real-Time RT-PCR灵敏度试验
将阳性标准品从质量浓度换算成摩尔浓度,取10μL已配制成109 copies/μL浓度的阳性标准品PES-DNA(PEDV-TGEV-PoRV),进行10倍比梯度稀释。使用以上2.3中的反应体系和条件进行Real-Time RT-PCR扩增,验证所建立的Real-Time RT-PCR方法的灵敏度。
1.2.6 临床应用与验证
从广东珠海、江门、中山、肇庆、佛山、阳江、广州、河源、揭阳、汕头、汕尾11个地市34个猪场采集产房仔猪腹泻样品(小肠及内容物),其中2016年样品18个,2017年样品26个。将小肠及内容物剪碎、匀浆,采用AxyPrep体液病毒DNA/RNA小量试剂盒提取RNA模板,应用本研究建立的三重Real-Time RT-PCR方法对所有样品进行检测。
为了验证检测结果的准确性,以相同的病毒RNA为模板,采用单重Real-Time RT-PCR对样品重复检测一次。反应体系为:2×Taq PCR Master mix 12.5 μL,逆转录酶和Taq酶各加0.5 μL,上游引物、下游引物和Taqman探针各1.0 μL(10 μmol/L),病毒RNA 2.0 μL,补水至25 μL。反应程序为:42℃ 5 min;94℃ 15 s,55℃ 40 s(收集荧光信号),40 Cycles。其中PEDV收集FAM通道荧光序号,TGEV收集VIC通道荧光信号,PoRV收集ROX通道荧光信号。
2 结果
2.1 反应体系建立
阳性标准品PES-DNA(PEDV-TGEV-PoRV)在试验条件下,预期的三条荧光曲线均获得了有效扩增,见图1,证实建立的Real-Time RT-PCR方法有同时检测PEDV、TGEV、PoRV三种病毒cDNA的可行性。
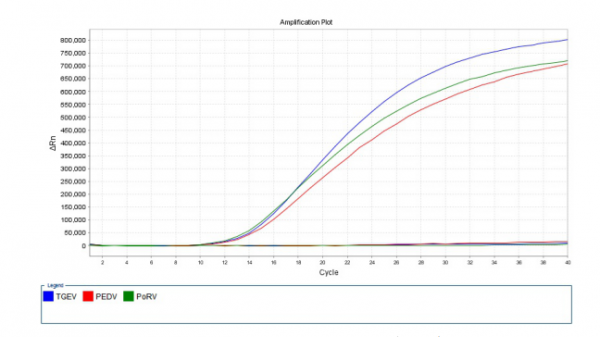
图1 三重Real-Time RT-PCR反应体系建立
2.2 特异性试验
5个反应管中,加入猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒RNA模板的反应管分别出现相应通道的荧光曲线,而加入猪急性腹泻综合征冠状病毒(SADS-CoV) 和猪瘟兔化弱毒RNA模板的体系均未出现任何荧光信号。猪急性腹泻综合征冠状病毒(SADS-CoV)是新近发现的一种引起猪腹泻的病毒,与PEDV、TGEV同为冠状病毒科成员;猪瘟兔化弱毒是使用最广泛、猪免疫频次最多的病毒抗原。通过检测与目标病毒在进化关系中相近的病毒或临床最常见的病毒抗原,证实了本研究建立的体系具有较好的特异性。见图2所示。
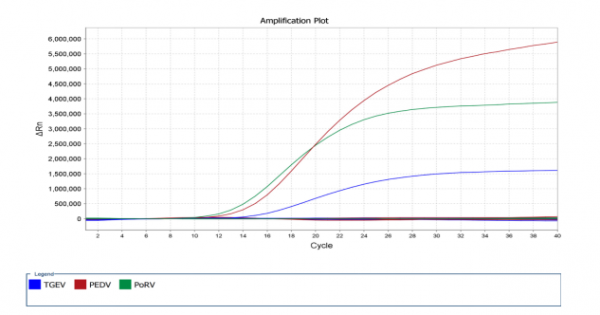
图2 三重Real-Time RT-PCR特异性试验
2.3 灵敏度试验
阳性标准品PES-DNA(PEDV-TGEV-PoRV)在108、107、106、105、104、103、102、101和100 copies/μL浓度模板的扩增曲线见图3,除了100 copies/μL浓度模板未获得有效扩增外,101~108 copies/μL浓度均收集到了荧光信号。因此,本体系能检测的模板最低浓度为101 copies/μL。
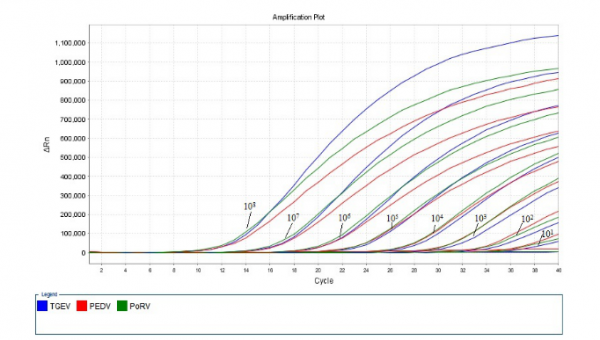
图3 三重Real-Time PCR灵敏度试验
2.4 临床样本检测与验证
44个临床样本,经三重Real-Time RT-PCR方法检测,2016年的18个样品PEDV阳性率100%,TGEV、PoRV全部为阴性,2017年26个样品同样是PEDV全部为阳性,TGEV、PoRV全部为阴性;且单重Real-Time RT-PCR的检测结果与三重Real-Time RT-PCR检测结果一致,见图4、图5。
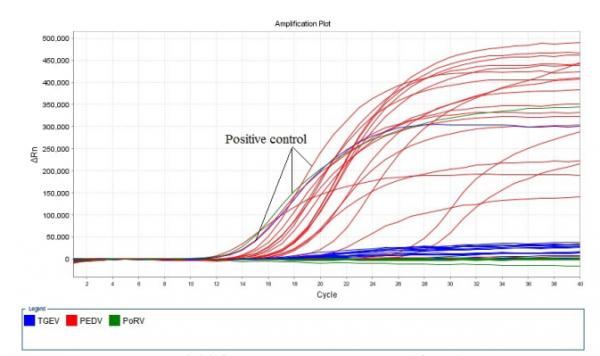
图4 临床样本三重Real-Time RT-PCR检测结果
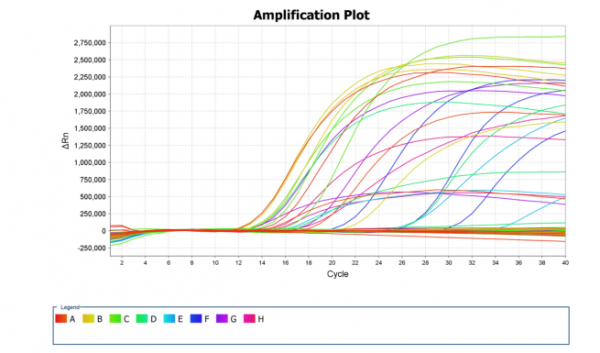
图5 临床样本单重Real-Time RT-PCR检测PEDV结果
3.讨论
猪病毒性腹泻已经成为困扰养猪企业产房新生仔猪饲养环节的顽疾,腹泻不容易防治的原因之一是,病原复杂,对病原判断的不精准,直接导致无法采取有效的预防措施。除了最常见的三大病毒性腹泻病原PEDV、TGEV、PoRV外,近年又发现了许多新的病毒,如δ冠状病毒、博卡病毒、Kobu病毒等,都可能与猪腹泻有关,但众多研究证实,传统的PEDV、TGEV、PoRV仍然是引起猪腹泻的重要诱因,在当前的腹泻病例中,PEDV仍然保持最高的检出率,且PEDV几乎可以与上述所有病毒混合感染。而TGEV从曾经的大流行,已经转为零星散发,检出率很低。PoRV还有一定量的检出率,但检出率的高低在不同的地区间有差异,另外跟样品量的多少也有关。周玲等对2016-2017年广东地区规模化猪场腹泻病原进行调查,结果显示PEDV是导致猪群腹泻的最主要病原,PoRV极少单独感染,TGE没有检出;田云等对2012-2013 年广东地区猪病毒性腹泻进行调查,其中2012年的236份腹泻样品中,PEDV、TGEV和PRoV的阳性率分别为33.5%、0和17.8%,TGE没有检出,而PoRV仍然有较高的检出率;未检测到PEDV与TGEV,PRoV与TGEV,PEDV、PRoV和TGEV的混合感染,只检到PEDV和PRoV极低的混合感染率(感染比例:7/566)。Zhang等(2013年)从我国11个省143个猪场采集腹泻病料985份,PEDV无论是单独感染还是混合感染,检出率均最高;没有检出TGEV的单独感染,仅在与PED混合感染病料中检出6份阳性样品;PRoV单独感染样品4份,但在与PEDV混合感染的病料中有较高的检出率。本研究中PEDV检出率为100%,但没有检测到混合感染,也没有检测到TGEV、PoRV单独感染,这可能与TGEV、PoRV局部地区较少流行、且PEDV越来越占优势的感染有关外,也可能与检测样品数量偏少有关。
细菌性的腹泻通过药物或疫苗往往可以得到比较好的防治效果,而病毒性腹泻无有效的治疗办法,最有效的预防措施是,对母猪进行针对性的免疫接种,使得仔猪通过获得充足的母源抗体而得到保护。本研究以及其他众多研究者的结果均证实,PEDV是引起当前猪病毒性腹泻最主要的病原体。因此适时对母猪接种PEDV疫苗,诱导足够的母源抗体,同时保持产房的清洁卫生,是防治新生仔猪腹泻的重要手段。现阶段我国预防猪病毒性腹泻的疫苗主要有两种:PEDV-TGEV-PoRV三联活疫苗和PEDV-TGEV二联灭活疫苗,鉴于当前PED的高发生率,结合近年PEDV流行毒株发生变异的可能,可以考虑筛选与流行毒株更加匹配的PEDV疫苗毒株,提高抗原滴度,研制生产PEDV单联苗的可行性。
三重Real-Time RT-PCR,样品上机一次,可以同时检测三种病原,省时省力,对当前仔猪病毒性腹泻的监测非常理想,采取该方法,有利于养殖场根据检测结果采取更精准的防控策略。Real-Time RT-PCR非常成熟,灵敏度高、特异性强,结果受常规操作的干预较小,但在本实验中,发现模板RNA的加样量以及储存时间对实验结果有一定的影响。在相同的条件下,模板RNA采用2μL和大于2μL的加样量,荧光曲线会稍有差别,其中2μL加样量的曲线更理想,这可能与三重反应体系中核酸片段较多,核酸总体浓度较高有关;RNA在-20℃的保存条件下,有逐步降解的倾向,三个月后的RNA较新提取的RNA在检出率上降低15%左右,因此对样品提取病毒RNA后应及时上机检测。
参考文献:略

